当前我国新冠疫情呈现散发趋势,局部地区感染人数快速提升,为进一步更早找出潜在感染者,2022年3月11日,国务院应对新型冠状病毒肺炎疫情联防联控机制综合组发文,为进一步优化新冠病毒检测策略,服务疫情防控需要,决定在核酸检测基础上,增加抗原检测作为补充。
2021年10月6日,WHO发布的抗原检测用于诊断SARS-CoV-2感染临时指导文件,也阐明抗原检测对于病毒载量高、处于感染初期的患者效果最好,在SARS-CoV-2患病率≥5%的环境下最为可靠。
我国应对新冠疫情的整体策略遵从“早发现、早报告、早隔离、早治疗”。病毒检测是实现早发现的重要手段。目前病毒检测的三种检测主要是核酸扩增检测(NAAT)、抗原检测和抗体检测,其中核酸扩增检测(NAAT)和抗原检测主要用于检测当前是否已感染病毒,抗体检测(也称血清学检测)主要用于检测过去是否感染病毒,无法判断是什么时候感染病毒的。
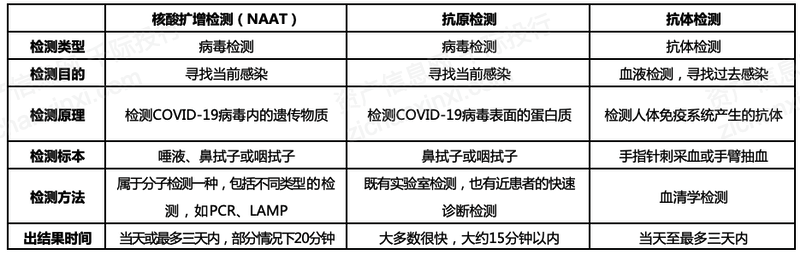
根据国家卫健委《关于印发新型冠状病毒感染的肺炎诊疗方案(试行第七版)》,新冠肺炎疑似病例若具备以下三大特征之一,可认定为确诊病例:(1)实时荧光RT-PCR检测新型冠状病毒核酸阳性;(2)病毒基因测序与已知的新型冠状病毒高度同源;(3)血清新型冠状病毒特异性IgM抗体和IgG抗体阳性;血清新型冠状病毒特异性抗体IgG抗体由阴性转为阳性或恢复期较急性期4倍及以上升高。前两种方法常称为核酸检测,第三种方法称血清学检测(抗体检测)。
核酸检测是新冠检测的“金标准”。抗体检测一般用作新型冠状病毒核酸检测阴性疑似病例的补充检测指标或疑似病例诊断中与核酸检测协同使用,不能作为新型冠状病毒感染的肺炎确诊和排除的依据,更适合回顾式检查。常见的核酸检测方法有病毒核酸特定基因检测(如PCR法)和基因组测序。《WHO新型冠状病毒指南》推荐首选通过RT-PCR进行新型冠状病毒检测,仅在无法使用RT-PCR时才建议使用血清学进行诊断。
核酸检测需经过采集、送检和处理三步骤。核酸提取(鼻咽拭子或下呼吸道样本)一般耗时30分钟至120分钟,核酸扩增时间在2小时之内,加上试剂准备、加样、结果分析等人工操作,整个流程耗时4-5小时。考虑样本在院内的流转时间,从患者取样到拿到检测结果一般至少需要6-8小时。
PCR操作技能要求严格,操作人员需经专业培训(持上岗证上岗),且需要在PCR认证实验室开展。基层医院实验室若不具备专业人员和设备设施,一般会将样本运送至有资质的实验室。

抗体检测(血清检查)是对血液中的抗体水平进行检测。病毒侵入后,会产生相应的特异性抗体进行防御,其中特异性抗体IgM最早产生并进行早期防御,随后产生IgG抗体。血清学检测通过检测血液样本中的特异性抗体IgM和IgG的存在及含量,来间接判断体内有无病毒及病毒感染情况。IgG是免疫球蛋白的主要成分,在IgM接近消失时,IgG的含量达到高峰,并在血中持续较长时间。
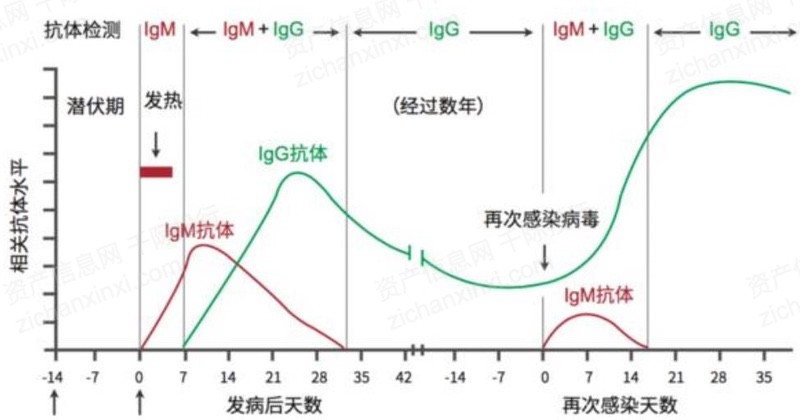
抗原检测直接检测病毒组成蛋白,因为抗原先于抗体而产生,因而抗原检测更适合早期大规模筛查。抗原检测可以通过侧向免疫层析(LFA)、酶联免疫吸附测定(ELISA)等方法。抗原检测一般灵敏度和准确度较低。香港卫生署发表研究论文,比较了商业化新冠病毒抗原检测盒(BIOCREDITCOVID-19Ag)与核酸检测的实际效果,实验结果表明抗原检测的检出率只有核酸阳性样本的11.1%-45.7%。因假阳性率较高,抗原检测仅可作为核酸检测的辅助手段。
当前国内北京金沃夫生物(乳胶法)和万孚生物(胶体金法)的抗原检测产品已获批上市(均为2020年11月获批)。
英国发现的B.1.1.7变异新冠病毒因为S基因N501Y等位点突变,提高S蛋白受体结合域(RBD)和宿主细胞ACE2亲和力,病毒传播能力增强70%。
突变主要位于S基因,当前尚无证据证明病毒突变可能会显著影响检测准确性,世卫组织此前公开表示:除少量仅针对病毒基因序列单一靶标产品受影响外,目前大多数检测工具针对基因序列上的多个目标,病毒变种不会影响此类检测。
国内圣湘生物、华大基因、凯普生物、捷诺生物等多家IVD企业已研发出新冠变异病毒株鉴定试剂盒。

我国新冠抗原检测产品市场空间预计超过300亿元。参考海外地区产品价格,欧洲地区获批品牌较多,单价(出厂价)约为6元,价格已经稳定;美国目前获批企业少,出厂价约为30元,假设远期价格稳定在15元。假设欧美地区每年人均使用次数10-20次,欧美抗原检测市场(美国、欧洲)规模约为1300亿元。根据广东省收费标准,目前我国院内抗原检测终端收费一人份32元,抗原检测产品进院价17元,估计目前出厂价12元,但考虑后续集采,假设我国抗原检测产品一人份出厂价5元,平均每人一年检测5次,预计我国抗原检测市场规模将达到350亿元。
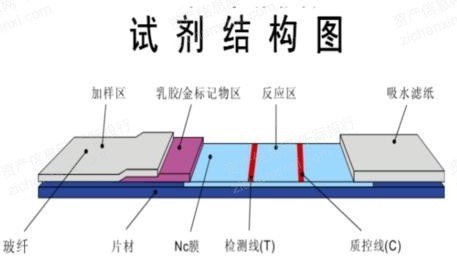
抗原检测试剂盒一般为胶体金免疫层析法,采用高度特异性的抗原抗体反应及免疫层析技术,试剂含有预先固定于NC膜上检测区的抗原/抗体和包被在标记垫上的抗原/抗体彩色标记物。其中主要的原材料生产所需材料可主要分为主材、辅材、包材。
抗原抗体。新冠抗原检测试剂盒中的抗体原料一般是以重组N蛋白或者S蛋白作为免疫原的抗体试剂。Spike(S)抗原和Nucleocapsid(N)抗原是新冠病毒两个重点靶点抗原。其中,N蛋白保守性更好且在病毒中含量最高,因此N蛋白是免疫诊断试剂开发的重要靶点。相关公司包含上市的诺唯赞、义翘神州、百普赛斯、优宁维、菲鹏生物(拟上市)等,还有一些海外供应商R&D、Pepro Tech等。
NC膜。硝酸纤维素膜的简称,在胶体金试纸中用做C/T线的承载体,同时也是免疫反应的发生处。目前供应商有MILLIPORE(美国)、WHATMAN andS&S、SARTORIUS(德国)、伊能(国产)、MDI(印度)、汕头润和生物(外资独资)等。
(2)辅材:种类与数量较多,以塑料件为主,有如瓶盖、滴头、卡壳等。相关的生产企业较多,上市公司中包含拱东医疗、昌红科技、阳普医疗、基蛋生物等;
(3)包材:主要为铝箔袋、纸盒等包装物,相对壁垒不高,生产厂家较多,供应商也多为印刷公司,上市公司中包含海顺新材、环球印务、科瑞技术等;
抗原国内获批以及海外获批均需要重点关注,截至2022年3月18日,我国NMPA批准的新冠抗原自检类试剂盒共有14款。
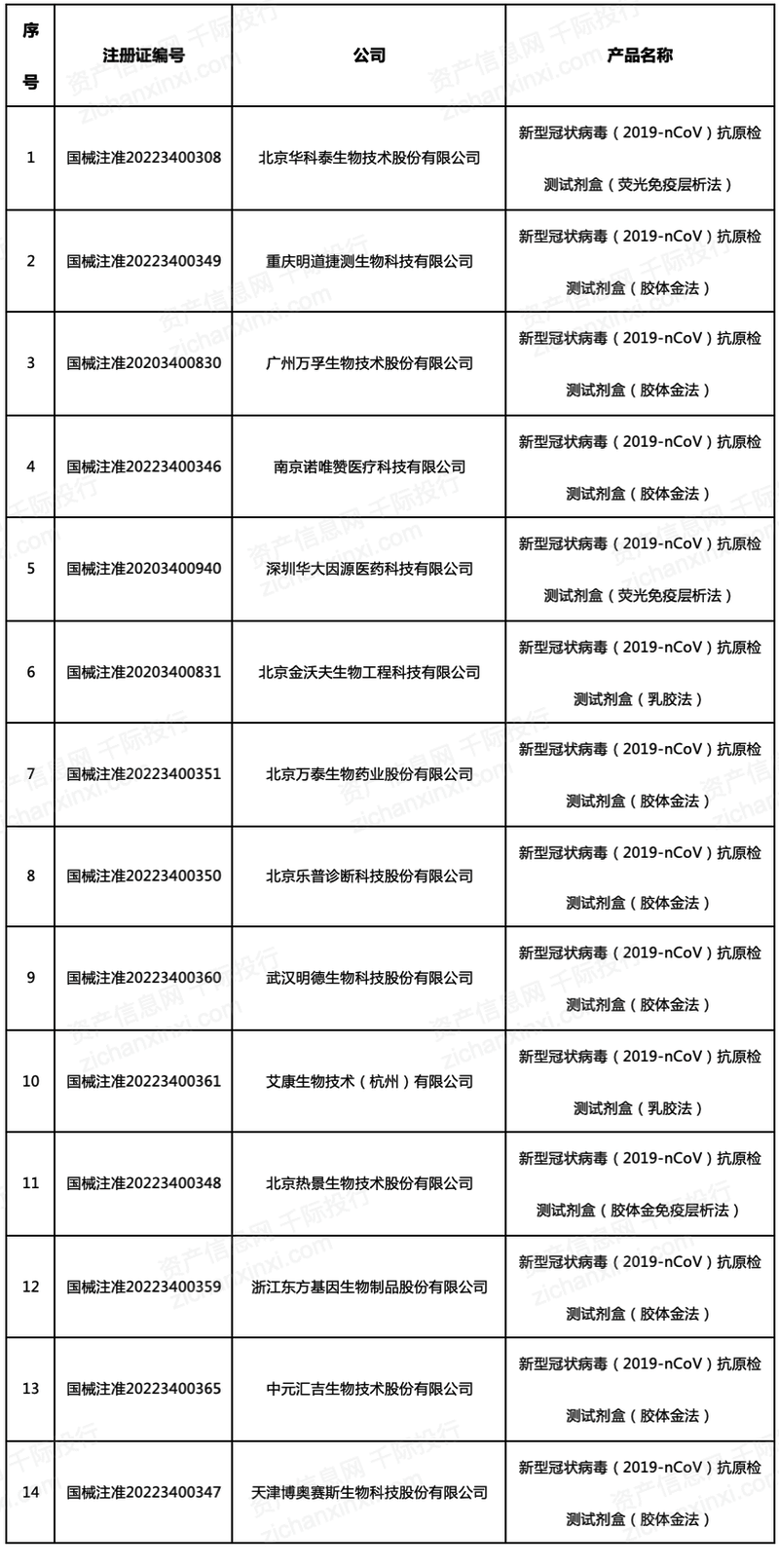

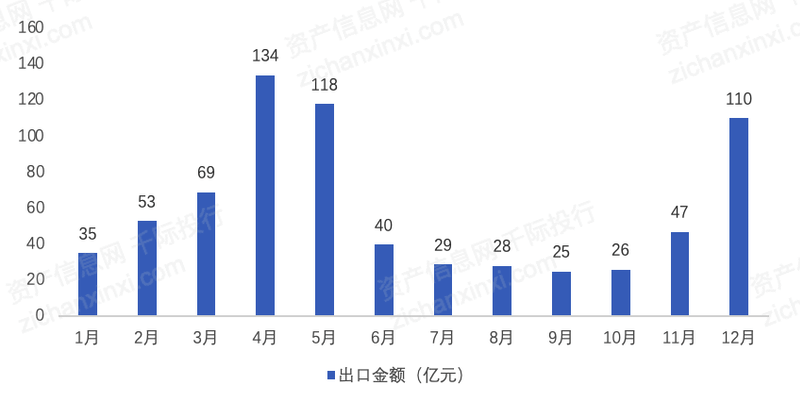
中国新冠抗原检测自检类试剂盒批准时间较欧洲、美国等地区晚,我国部分公司的抗原检测产品也已在欧洲或美国得到批准并市场销售。2021年全年,中国新冠检测试剂盒(核酸检测+抗体检测+抗原检测)合计出口金额约714亿元,浙江、福建和广东是主要的出口省份,进口国家主要是德国和英国。
欧洲市场,用于家用检测抗原检测试剂产品较多,价格战激烈,终端价格约在2-3欧元左右。以德国为例,我国的艾康生物、安旭生物、万泰生物、热景生物、明德生物、博拓生物等公司产品均被德国药监局批准用于家用,其他公司如万孚生物、亚辉龙、东方生物、乐普生物等产品也获得CE认证。
美国市场FDA对家用新冠抗原检测试剂盒的审批较为严格,市场竞争格局较优,我国仅有三家公司拿到美国的EUA,分别是艾康生物、九安医疗和东方生物(为西门子的代工商)。
考虑到中国国内抗原检测潜在需求,预计已经拿到CE认证和美国EUA证的公司也会加速在国内进行注册申请。
按照《新冠病毒抗原检测应用方案(试行)》的要求,抗原检测的应用场景抗原分为大体分为两种,一是基层医疗卫生机构的采样检测,二是隔离观察人员以及社区居民的自测。
(1)采样检测:根据《基层医疗卫生机构新冠病毒抗原检测基本要求及流程》的要求,基层医疗卫生机构的采样检测流程类似于目前的核酸检测,不过更多的是针对不具备核酸检测能力的基层医疗机构,是对核酸检测的一个补充。
因此,不同场景、不同人群所代表的下游终端是不同的,按照目前核酸检测的情况推断,基层医疗机构和自测的隔离观察人员的检测采购方应该会采取政府招标采购,而明确了自费的社区居民自测则为个人消费。
招采方面,广东已经走在前列。根据2021年5月《广东省药品交易中心关于公布新型冠状病毒(2019-CoV)检测试剂联盟地区集团带量采购中选价格信息的通知》,其中新冠抗原检测试剂盒中标价位16.8元/人份。

零售方面,规定可以在零售药店、网络销售平台等渠道购买。2022年3月12日,零售药店上市公司老百姓、大参林和医药电商生力军叮当快药都宣告,以最快速度响应居家抗原自测。
一方面零售药店作为最前线的医疗终端之一,在新冠爆发初期的2020年就起到排头兵的关键作用,在新冠抗原检测试剂盒的患者教育和医疗服务上有不可或缺的作用;另一方面,医药电商在疫情期间异军突起,若疫情动态清零下居家自测需求逐渐变为刚性,长期性的囤货式购买是电商优势所在。
抗原检测试剂盒产业链按照的前文介绍,可以划分为上游原材料、中游产品制造生产以及下游的终端销售。
根据行业相关毛利率水平对行业毛利分配做出测算,测算后以终端销售价为基。
米乐app官网登录



